Las propiedades coligativas son propiedades que dependen sólo del número de partículas de soluto en la disolución y no de la naturaleza de las partículas de soluto (si son moléculas, atómos o iones). Las propiedades coligativas son la disminución de la presión de vapor, la elevación del punto de ebullición, la disminución del punto de congelación y la presión osmótica. Debe considerarse que las disoluciones para las cuales se estudian las propiedades coligativas serán relativamente diluidas; para concentraciones menores a 0,2 molar.
En esta oportunidad se trata la disminución del punto de fusión. Un ejemplo clásico es que el hielo en las carreteras y banquetas congeladas, se derrite cuando se le espolvorean sales como cloruro de sodio o cloruro de calcio. Este método funciona porque disminuye el punto de congelación del agua.
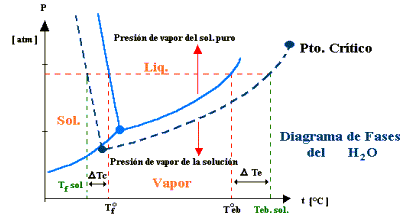 Nuevamente al observar el diagrama de fases, se ve que la curva sólido-líquido se desplaza hacia la izquierda, al disminuir la presión de vapor. Como consecuencia el punto de congelación disminuye, sea cual sea la presión atmosférica.
Nuevamente al observar el diagrama de fases, se ve que la curva sólido-líquido se desplaza hacia la izquierda, al disminuir la presión de vapor. Como consecuencia el punto de congelación disminuye, sea cual sea la presión atmosférica.
La explicación cualitativa de a disminución del punto de congelación implica una transición de un estado desordenado a un estado ordenado. Para que esto suceda, el sistema debe liberar energía. Como en una disolución hay mayor desorden que en el disolvente puro, es necesario que libere más energía para generar orden. Por tanto, la disolución tiene menor punto de congelación que el disolvente.
Para la disminución del punto de congelación, el soluto puede ser volátil o no volátil (a diferencia de la elevación del punto de ebullición donde el soluto debía ser no volátil). Por ejemplo, el metanol, que es un líquido bastante volátil, se utiliza como anticongelante en los motores de los autos.
